1 はじめに
私たちは、3年間行ってきたタンパク質の研究を通して、電気泳動の原理を利用したタンパク質の精製方法を確立した。今年度はその方法を利用して唾液、すい液、尿および血液から検出され、デンプンを糖に分解することが知られている消化酵素アミラーゼの精製を試みたので報告する。
2 実験方法
アミラーゼの活性測定
アミラーゼはデンプンを糖に分解することが知られているので、基質のデンプンが酵素のアミラーゼとの反応後にどれだけ残っているかをヨウ素デンプン反応で検出して、アミラーゼの活性測定を試みた。
電気泳動
タンパク質はアミノ酸が多数ペプチド結合した重合体で、構成するアミノ酸や立体構造の違いで正または負の電荷を持つことを利用してタンパク質を分離した。
タンパク質のゲルからの抽出
電気泳動後のゲル中にアミラーゼ活性が確認できた部分から切り出したゲルから自作の抽出装置を利用してタンパク質を抽出した。
3 実験結果
アミラーゼの活性測定条件の検討
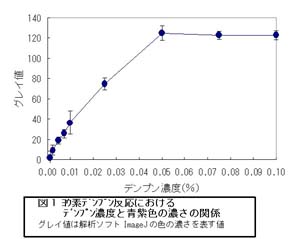
0.001%~0.100%の範囲で調製したデンプン溶液にヨウ素液を加えて青紫色の濃さを測定した。その結果、0%~0.050%まではほぼ比例関係にあったので、アミラーゼとの反応後に残存するデンプン濃度が0%~0.050%の範囲であれば、アミラーゼ活性を測定可能であることがわかった(図1)。
唾液アミラーゼの精製
(1)唾液のアミラーゼ活性
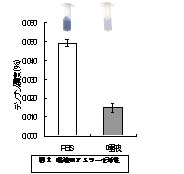
まず、唾液中にアミラーゼが存在するかどうかを確かめるためにアミラーゼの活性測定を行った。対照としてリン酸緩衝溶液(PBS)を用いた方はヨウ素デンプン反応を示し、唾液の方は示さなかった。このことより唾液中にアミラーゼが含まれることがわかった(図2)。
(2)NATIVE電気泳動
(1)で唾液中にアミラーゼが存在することがわかったので、唾液からアミラーゼを精製しようと考えた。まず、未変成の状態でタンパク質を泳動できるNATIVE電気泳動という方法で唾液中のタンパク質を調べた(図3a)。
次に、唾液中のタンパク質の中でアミラーゼの場所を特定するために、泳動後のゲルの上に薄いデンプンの膜であるオブラートを静かに乗せて、半日反応させた。その後、ヨウ素デンプン反応を行ったところ、反応しない部分が現れた(図3b)。

(3)タンパク質の抽出とアミラーゼ活性
(2)で行ったヨウ素デンプン反応で、反応しなかった部分は、ゲル中のアミラーゼとオブラート(デンプン)が反応したと考えた。全泳動距離を1として、反応した部分の移動度を計算したところ、ゲルの先端から0.13~0.25の位置であった(図3b)。その部分のゲルを切り出し、自作の抽出装置を用いてタンパク質を抽出した。
抽出したタンパク質にアミラーゼ活性があるかどうかをPBSを対照として調べたところ、明らかにアミラーゼ活性があることが確認できた。
(4)SDS電気泳動
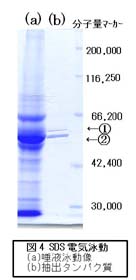
(3)でアミラーゼ活性が確認された抽出タンパク質が単一のタンパク質なのか確かめるために、SDS電気泳動を行った(図4)。その結果、バンドが2本現れた。また、電気泳動の結果から、縦軸にLog10分子量、横軸に移動度をとり、表計算ソフトExcelを使って近似直線を求め、分子量を計算した。その結果、バンド①、バンド②の分子量は、それぞれ約62,000、約56,000であることが分かった。
4 考察
ヨウ素デンプン反応は、今まで、デンプンの有無を判断するだけの反応であると思っていたが、今回の実験を通してデンプン濃度によって青紫色の濃さが変化することがわかった。さらに、デンプン濃度が0%~0.050%の範囲であれば、濃度と色の濃さはほぼ比例するので、ヨウ素デンプン反応がアミラーゼの活性測定に利用可能であることがわかった(図1)。活性測定に関する他の条件についても様々な実験を行った結果、唾液は酵素液中の体積は5μL、反応時間は3分間、溶液のpHは7、反応温度は37℃が最適な条件だとわかった。
次に、唾液中のアミラーゼの精製を試みた。まず、NATIVE電気泳動後のゲル中のアミラーゼの位置を特定しようと考えた。特定方法として、デンプンと泳動後のゲルを反応させようと考え、さまざまな実験を行った。その結果、湿る程度にPBSを滴下したオブラートとゲルを半日ほど反応させた後にヨウ素液を滴下したところ、ゲル中のタンパク質に反応してオブラートが分解した部分が確認できた(図3b)。オブラートが分解した部分のゲルから抽出した抽出液にはアミラーゼが含まれることがわかった
。次に、抽出したタンパク質の分子量を調べるために、SDS電気泳動を行ったところ、バンドが2本見られた(図4)。通常、タンパク質が精製できた場合、SDS電気泳動をすると、バンドが1本しか見られないので、初めは失敗だと思った。しかし、参考文献でその原因を調べたところ、一部のアミラーゼはオリゴ糖鎖と結合していることがわかった。さらに、この2本のバンドの分子量を計算すると、約62,000と約56,000であり文献の値とほぼ一致したので、私たちが精製した2本のバンドはどちらもアミラーゼであることが明らかになった。
5 今後の課題
アミラーゼとストレスが関係あるかどうかを調べてみると、ストレスを与えられるとアミラーゼの活性が高まることがわかった。さらに電気泳動の結果から、アミラーゼ活性の高い唾液中ではアミラーゼ濃度が高まっていることがわかった。また、参考文献によると、唾液の分泌には、自律神経系が関係していることがわかった。自律神経系には交感神経と副交感神経がある。一般には、興奮時や緊張時には交感神経が働き、リラックスしている時には副交感神経が働く。ストレスは緊張状態にあるので、交感神経が働いているということになる。また、交感神経が働くと、唾液の分泌が促進されることが知られている。これらのことから、ストレスが働くと、唾液中のアミラーゼ濃度が高まった上に、分泌量が増加するので、唾液中には非常に多くのアミラーゼ分子が存在することがわかった。
以上により、今後はストレスとアミラーゼの関係についてもう少し調べたい。
6 謝辞
抽出装置に対する助言をくださった、北海道大学低温科学研究所 落合正則先生に感謝を申し上げる。
○いしわか さとし・こばやし ひろまさ・ゆたに けいすけ・たにぐち ともあき・ふじい ゆりな・ おのでら しゅん・たにうち
さつき
この度は、奨励賞というとても名誉ある賞を頂きありがとうございました。普段の取組みの成果が評価されてとても嬉しいです。来年もこの賞の受賞を目標に、こつこつと研究を行っていきたいと思います。